L’invention de la physiologie : le développement
La différenciation du sexe chez les mammifères:
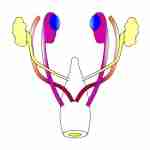 L’anatomie de l’appareil génital des mammifères adultes fut décrite dès l’Antiquité par le Grec Claude Galien et, au XVIe siècle, le médecin flamand André Vésale en livra une illustration des plus précises. En revanche, il fallut attendre le XVIIIe siècle et le XIXe siècle pour que soient publiés les premiers travaux rela¬tifs à l’anatomie de l’appareil génital embryonnaire. C’est ainsi que, dans les voies génitales embryonnaires encore indifférenciées, les médecins allemands Caspar Friedrich Wolff (1733-1794) et Johannes Peter Müller (1801-1858) identifièrent, en 1759 et en 1833, les canaux qui porteront leurs noms.
L’anatomie de l’appareil génital des mammifères adultes fut décrite dès l’Antiquité par le Grec Claude Galien et, au XVIe siècle, le médecin flamand André Vésale en livra une illustration des plus précises. En revanche, il fallut attendre le XVIIIe siècle et le XIXe siècle pour que soient publiés les premiers travaux rela¬tifs à l’anatomie de l’appareil génital embryonnaire. C’est ainsi que, dans les voies génitales embryonnaires encore indifférenciées, les médecins allemands Caspar Friedrich Wolff (1733-1794) et Johannes Peter Müller (1801-1858) identifièrent, en 1759 et en 1833, les canaux qui porteront leurs noms.
Les premières hypothèses quant à la différenciation mâle ou femelle des voies génitales furent émises à partir de l’observation des gestations gémellaires chez les bovins, où elles sont relativement fréquentes. Lorsque les deux fœtus étaient de sexe différent, la femelle présentait, lors de la mise bas, des organes génitaux externes anormaux: ils étaient masculinisés. Ces femelles stériles furent appelées «mules» dans les campagnes françaises et «free-martins» en Grande-Bretagne, terme probablement constitué à parti du dialecte écossais «ferry», pour stérile, et «mart», désignant un bœuf destiné à la boucherie et vendu à la foire de la Saint-Martin.
S’intéressant aux free-martins, l’embryologiste américain Franck R. Lillie (1870-1947) émit, en 1916, l’hypothèse que les hormones sexuelles produites par le fœtus mâle, transportées par des anastomoses vasculaires existant entre les deux fœtus, exerçaient un effet masculinisant majeur sur l’ovaire et, dans une moindre mesure, sur les voies génitales du fœtus femelle. En 1925, Robert K. Burns (1896- 1982) reproduisit 1’« effet free-martin» en réalisant des expériences de parabiose, c’est- à-dire en soudant des larves d’amphibiens flanc contre flanc. Il pratiqua également des greffes orthotopiques chez l’axolotl, qui correspond à la larve de l’ambystome. Cette technique consistait à ôter, chez un axolotl, la région abdominale comprenant les gonades mâles, et à la greffer chez une femelle dans la région du corps équivalente, puis à 1’enlever avant que l’animal n’atteigne sa maturité
sexuelle. L’expérience conduisait à la masculinisation des femelles, ce qui laissait effectivement supposer l’existence d’un mécanisme de différenciation du tractus génital impliquant une hormone masculinisante. Il fallut attendre le milieu du XXe siècle pour que soient réalisées les premières études expérimentales sur les ébauches embryonnaires des voies génitales.
L’expérience de Jost (1947):
Dès 1939, le biologiste français Alfred Jost (1916-1991), qui travaille au Collège de France, consacre ses recherches à l’endocrinologie de la gestation. Il tente en particulier de comprendre l’implication du testicule sur le développement des voies génitales chez l’embryon de lapin. Grâce à une technique de chirurgie in utero qu’il met au point, Jost est capable d’accéder aux voies génitales en formation du fœtus de lapin. Dès lors, il lui est possible de réaliser tous les actes techniques fondamentaux permettant de mettre en évidence la fonction endocrine d’un tissu : ablation et greffe de ce dernier, puis étude de l’action biologique de molécules ou d’extraits tissulaires.
Jost s’intéresse aux processus qui gouvernent l’évolution des canaux Wolff et des canaux de Müller: chez le mâle, les premiers se différencient et forment l’épididyme alors que les seconds régressent ; chez la femelle, ce sont les premiers qui régressent et les seconds qui se différencient en oviductes. Le chercheur étudie trois lots d’embryons de lapin.
Il observe que la castration, quelle soit pratiquée chez le fœtus mâle ou chez le fœtus femelle, induit un maintien des canaux de Müller et une régression des canaux de Wolff, c’est-à-dire une féminisation des voies génitales. Chez un fœtus femelle, la greffe unilatérale de testicule provoque la régression ipsilatérale (du côté de la greffe) du canal de Müller et la différenciation, du même côté, du canal de Wolff en épididyme. La mise en place d’un cristal de testostérone, hormone produite par le testicule qui a été isolée dans les années 1930, n’induit pas la régression du canal de Müller et permet le maintien et la différenciation du canal de Wolff.
Jost met donc en évidence le double rôle du testicule dans la masculinisation des voies génitales : d’une part, il sécrète de la testostérone, une hormone qui stimule la différenciation du canal de Wolf en voies génitales mâles et, d’autre part, il est impliqué dans la régression des canaux de Müller.
Cette seconde action est médiée par un facteur testiculaire autre que la testostérone, que Jost nomme dans un premier temps l’hormone inhibitrice, avant de proposer le terme d’hormone anti-Müllérienne, ou AMH, qui sera finalement retenu. Par la suite, dans les années 1970, l’AMH sera isolée par l’équipe de Jost dans des cultures de testicules de veau. Les résultats de l’expérience de 1947 suggèrent que l’ovaire ne joue aucun rôle dans- la différenciation des voies génitales femelles, qui se féminisent «par défaut» chez un embryon femelle comme chez un embryon mâle castré. Cette idée est actuelle¬ment remise en cause.
D’autres étapes clés:
Dans les années 1960, des études de caryotypes menées dans l’espèce humaine permet¬tent de vérifier le rôle déterminant du chromosome Y dans l’établissement du phénotype sexuel masculin. Ainsi, des sujets ne présentant qu’un seul chromosome sexuel X sont de phénotype féminin, alors que la présence d’un chromosome Y induit un phénotype masculin quel que soit le nombre de chromosomes X.
Trente années plus tard, en 1990, le gène sry (pour sex determining region Y) est découvert suite à l’analyse, chez des hermaphrodites vrais, de translocation de petits fragments du chromosome Y sur le chromosome X. Ces premières observations sont confirmées l’année suivante par les travaux d’une équipe australienne dirigée par Peter Koopman. Cette dernière démontre que, chez la souris, l’expression de sry précède la différenciation de la gonade indifférenciée de l’embryon en testicule. Elle établit en outre que des souris XX transgéniques pour sry présentent un phénotvpe mâle normal.
Le contrôle de la métamorphose des amphibiens:
A la fin du XIXe siècle et au début du XXe siècle, l’étude des « sécrétions internes » prit une place grandissante chez les physiologistes. Ainsi, en 1902, la première hormone, fut découverte par les physiologistes britanniques William Bayliss (1860-1924) et Ernest Starling (1866-1927), et, un an plus tard, les embryologistes français Pol Bouin et Paul Ancel mirent en évidence le rôle endocrine de certaines cellules du testicule. C’est dans ce contexte qu’un professeur d’anatomie américain, Joseph Friedrich Gudernatsch (1881-1962), entreprit de caractériser les mécanismes de contrôle de la croissance et de la métamorphose des amphibiens. Ses expériences furent menées entre 1911 à 1914 et consommèrent… 2 000 têtards de grenouille verte (Rana esculenta), de grenouille rousse (Rana temporaria) ou de crapaud (Bufo vulgaris)…
L’expérience de Guternatsch (911 et 1912):
La première étude de Guternatsch est réalisée avec des têtards de grenouille rousse âgés d’une semaine. Certaines larves sont nourries de fragments de thyroïde, de foie ou de muscles prélevés chez des chevaux, ou bien encore d’ovaires de mouton. Leur déve-loppement est comparé à celui d’un groupe témoin dont l’ali-mentation est exclusivement constituée de végétaux (élodée du Canada et cornifle nageant). Le développement des amphibiens est suivi pendant 15 semaines.
Les fragments d’ovaires de mouton ou de muscles de cheval sont sans action sur le développe-ment des têtards des grenouilles rousses qui, lorsqu’elles en sont nourries, se métamorphosent en 15 semaines, de même que les animaux ayant mangé des végé-taux. Le foie possède un léger effet accélérateur du développement, avec une métamorphose interve¬nant 4 semaines plus tôt chez les animaux qui s’en sont nourris que chez les témoins. Mais ce sont les têtards alimentés par des fragments de thyroïde qui présentent la métamorphose la plus précoce : celle-ci intervient en 4 semaines, soit un temps réduit de 75 % par rapport aux têtards soumis au régime exclusivement végétal. Dans ce cas néanmoins, la taille des individus obtenus est très faible, peu différente de celle des têtards en début d’expérience.
Dans une seconde étude, Guternatsch utilise des têtards de crapaud Bufo vulgaris afin de tester l’influence de la thyroïde sur le délai d’apparition de la métamorphose. Les têtards sont nourris de fragments de cet organe pendant une période de 1, 2 ou 5 jours, avant d’être soumis à un régime à base de végétaux. Le développement des amphibiens est analysé sur une durée totale de 20 jours.
Pendant ce laps de temps, la métamorphose n’est observée que pour le groupe nourri durant 5 jours consécutifs avec des fragments de thyroïde. Elle intervient au bout d’en¬viron 3 semaines, ce qui est deux fois plus rapide que chez les têtards témoins, qui se métamorphosent en 6 semaines.
Le développement des membres postérieurs est d’au¬tant plus précoce que la durée de nourrissage des têtards avec de la thyroïde augmente. Il s’agit ici d’un effet «dose-réponse» de l’action des fragments de cet organe.
Se fondant sur l’ensemble de ses expérimentations, Gudernatsch conclue au rôle prépondérant de la thyroïde sur la métamorphose des amphibiens :
«Les expérimentations de 1911 et 1912 ne laissent pas de doute sur le fait que la glande thyroïde des mammifères contienne un agent qui, lorsque la glande est donnée comme nourriture, déclenche une différenciation rapide d’un organisme vertébré en développement […] mais ne possède pas d’effet sur la croissance. »
D’autres étapes clés:
En 1916, le chirurgien américain Bennett M. Allen reprend le principe du nourrissage de têtards avec des fragments de thyroïde. Il utilise des morceaux issus de 21 thyroïdes tumorales prélevées chez des patients hospitalisés, dont la teneur en iode a auparavant été déterminée. Il observe une corrélation entre l’action physiologique de la thyroïde sur le déclenchement de la métamorphose et sa teneur en iode.
En 1927, une première hormone thyroïdienne, la thyroxine, est synthétisée par deux Britanniques, le biochimiste Charles Robert Harington (1897-1972) et le chimiste George Barger (1878-1939). Dès lors, il devient envisageable d’étudier les effets de cette molécule sur la métamorphose des amphibiens.
Par exemple, il est possible d’introduire de la thyroxine dans l’eau d’un aquarium, dans lequel on laisse séjourner des têtards pendant un temps variable. Au bout de 15 jours, l’aquarium témoin contient encore des têtards, alors que celui dont l’eau a été additionnée de thyroxine renferme des grenouilles ayant quasiment achevé leur métamorphose (il ne leur reste qu’un fragment de queue résiduel). L’expérience montre donc que la thyroxine accélère le processus de métamorphose.
Le contrôle de la métamorphose des insectes:
Si la métamorphose des insectes a été décrite dès le XVIIe siècle par le biologiste et microsco- piste hollandais Jan Swammerdam (1637-1680), l’étude des mécanismes contrôlant ce phénomène n’a été abordée qu’au XXe siècle. Il est tout d’abord apparu que la partie antérieure du corps de l’insecte était impliquée. En 1917, le biologiste polonais Stefan Kopec (1888- 1941) réalisa une ligature à mi-longueur du corps chez une chenille de bombyx disparate (Lymantria dispar). Lorsque l’opération était effectuée précocement (2 à 3 jours après la dernière mue larvaire), seule la partie antérieure du corps subissait la métamorphose, condui¬sant à la formation d’une hémichrysalide. Si la ligature était posée tardivement, toute la chenille se métamorphosait. Kopec étudia ensuite les effets d’une décérébration de la larve et observa que, si elle était effectuée suffisamment tôt, elle inhibait la métamorphose. Il démon¬tra ainsi l’existence d’une période critique au cours de laquelle la tête de l’insecte jouait un rôle prépondérant dans le déclenchement de la métamorphose. A partir de 1930, le médecin britannique Vincent Brian Wigglesworth (1899-1994), diplômé de médecine tropicale, passionné d’entomologie et convaincu que toutes les questions de la physiologie pouvaient être abordées à partir de l’étude des insectes, commença des travaux sur la métamorphose. Un petit parasite, Rhodniusprolixus, allait alors se trouver à l’origine de grandes découvertes…
L’expérience de Wigglesworth (1934):
Rhodnius prolixus est un ectoparasite hématophage des mammifères et des oiseaux. C’est le vecteur du trypanosome qui, en Amérique centrale, provoque la maladie de Chagas. Cet insecte présente 5 stades larvaires séparés par 4 mues larvaires, la dernière mue, ou mue imaginale, donnant l’adulte (imago). Rhodnius constitue un modèle expérimental de choix car, à 25 °C, la mue imaginale se produit exactement 28 jours après la dernière prise alimentaire constituée d’un repas de sang. De plus, l’adulte se distingue aisément des larves grâce à des marqueurs cuticulaires. Enfin, les larves sont très robustes : elles survi-vent par exemple très bien… à la décapitation !
Wigglesworth reprend les techniques de décapitation de Kopec. Il réalise également des parabioses en réunissant deux larves décapitées par un tube capillaire.
La décapitation de la larve n’empêche la mue imaginale que si elle est pratiquée avant le 7e jour qui suit le dernier repas de sang. Wigglesworth montre ainsi que ce 7e jour est une période critique pour l’accomplissement de la mue imaginale. Dans le cas d’une para- biose de deux larves, l’une décapitée avant la période critique (larve 1), l’autre après (larve 2), puis reliées par un tube capillaire, les deux individus opérés subissent, de façon synchrone, la mue imaginale. La larve 2 a ainsi déterminé la métamorphose de son parte-naire qui, dans des conditions normales, n’aurait pas pu se réaliser. Le corps de cette larve décapitée après la période critique contient donc une substance, élaborée dans la région céphalique, qui a diffusé dans l’hémolymphe de la larve 1 et induit sa mue imaginale.
Wigglesworth prouve par cette expérience que le signal déclencheur de la mue imagi-nale est un facteur hormonal produit au niveau de la tête de l’insecte. Ce dernier doit être émis, soit de manière transitoire, soit pendant une durée minimale (existence d’une période critique) et il est diffusible, puisqu’il transite dans l’hémolymphe.
D’autres étapes clés:
Dans la foulée des expériences de décapitation et de parabiose, Wigglesworth montre que si la chaîne nerveuse ventrale est sectionnée après un repas de sang, la mue ha pas lieu. Il prouve ainsi que la distension de l’abdomen consécutive au repas de sang est le stimulus initial qui atteint le cerveau par voie nerveuse. L’existence de cellules neurosécrétrices est ensuite démontrée au niveau de la partie dorsale du cerveau de l’insecte (fars intercerebralis).
Wigglesworth poursuit ses recherches consacrées au déterminisme de la métamor¬phose chez les insectes en pratiquant l’ablation des corps allates, des structures endocrines en relation avec le cerveau, chez de jeunes larves de Rhodnius (3e stade). Il obtient alors des adultes nains. Au contraire, la greffe de corps allates d’une larve jeune (3e ou 4e stade) à des larves du 5e stade induit une mue larvaire supplémentaire et la formation d’une larve géante (6e stade). Wigglesworth établit ainsi que les sécrétions des corps allates, déversées dans l’hémolymphe, s’opposent à la mue imaginale et stimulent la croissance de la larve.
Les corps allates sécrètent l’hormone juvénile (JH). En 1944, le biologiste japonais Soichi Fukuda (1907-1984) précise le rôle des glandes prothoraciques dans la métamorphose des insectes. Il greffe cet organe, prélevé chez une chenille âgée de Bombyx mori (6 jours après la dernière larvaire), dans l’abdomen d’une chenille jeune (juste après la dernière mue larvaire). Six jours après la greffe, il ligature l’abdomen en avant du greffon. Il obtient une chrysalide complète. Une chenille témoin, ligaturée de la même manière 6 jours après la dernière mue larvaire, produit une hémi-chrysalide: seule la partie avant de la chenille subit la mue imaginale, la partie arrière restant larvaire. Fukuda montre ainsi que la glande prothoracique constitue un organe endocrine impliqué dans le déclenchement de la métamorphose chez les insectes.
Vidéo : L’invention de la physiologie : le développement
Vidéo démonstrative pour tout savoir sur : L’invention de la physiologie : le développement
