Ictère néonatal
Définitions et rappels physiologiques :
L’ictère :
Couramment appelé « jaunisse », l’ictère est la coloration jaune de la peau, des muqueuses (couche de cellules de protection recouvrant les organes creux en contact avec l’extérieur) et du blanc de l’œil (la sclérotique). L’ictère correspond à une hyper-bilirubinémie (taux anormalement élevé de bilirubine dans le sang).
Cycles de la bilirubine :
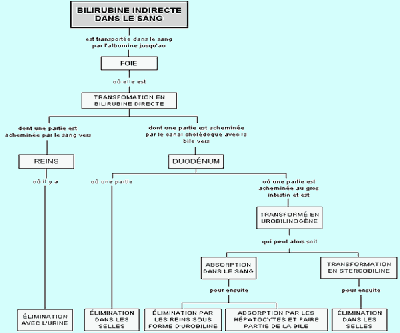
La bilirubine est un pigment biliaire, de coloration jaune rougeâtre ou brunâtre, issu de la biliverdine, elle-même issue de l’hémoglobine (constituant principal des globules rouges, destiné à transporter l’oxygène dans le sang). La bilirubine est le principal colorant de la bile.
Les globules rouges vivent en moyenne 120 jours, ce qui signifie qu’ils doivent être détruits et remplacés par de nouveaux au bout de cette période. Cette destruction se fait par des cellules phagocytaires, aussi appelées macrophages, qui se trouvent dans les capillaires de la rate, du foie et de la mœlle osseuse. Ces cellules phagocytaires ont pour rôle de capturer les microorganismes indésirables ou les vieilles cellules, de les englober et de les digérer. Le rôle des macrophages est donc de débarrasser le sang des globules rouges vieillis. Il semble que des modifications au niveau de la membrane cytoplasmique dues au vieillissement de ces globules rouges réduisent leur souplesse de sorte qu’ils restent immobilisés dans les capillaires de la rate par exemple ( qui joue ainsi le rôle de filtre) permettant ainsi aux macrophages de les distinguer des plus jeunes et de les phagocyter. Une fois le globule rouge englobé par le macrophage, sa membrane est digérée de telle sorte que l’hémoglobine soit libérée et aussitôt dégradée en ses constituants de base par les enzymes de dégradation du macrophage. On obtient alors deux composants : de la globine et le groupement hème. Il s’agit ensuite de récupérer le matériel réutilisable. Ainsi, les acides aminés résultant de la dégradation de la globine sont envoyés dans le sang afin d’être réutilisés par les cellules de l’organisme, l’hème est ensuite dissocié en deux composants : fer et porphyrine. Le fer est transporté dans le sang et mis en réserve dans les cellules du foie ou de la rate où il peut également servir à la production de nouveaux globules rouges dans la mœlle osseuse. La porphyrine est convertie en un pigment, la bilirubine indirecte (bilirubine libre). À moins que la dégradation du globule ne se fasse dans le foie, cette bilirubine indirecte est envoyée dans le sang pour être transportée vers le foie. Cette molécule est insoluble dans l’eau et voyage dans le sang grâce à une protéine plasmatique, l’albumine. Ainsi la bilirubine indirecte venant des globules rouges dégradés et dans la rate et dans le foie se trouve en fin de compte et en totalité au niveau du foie où elle est transformée en bilirubine directe (bilirubine conjuguée) par l’intermédiaire d’une enzyme spécifique aux cellules du foie (qui ne se trouve que dans les cellules hépatiques). La majeure partie de cette bilirubine directe est déversée dans la bile et est alors périodiquement libérée dans le duodénum lors de la digestion. Le reste est déversé dans la circulation sanguine, ce qui explique qu’une personne normale a de la bilirubine directe dans son plasma, cette bilirubine sanguine est alors éliminée par les reins.
Une fois dans le tube digestif, la bilirubine directe subit des transformations pour donner l’urobilinogène dont une partie est transformée en stercobiline (un pigment brun, qui donne leur coloration aux selles) par les microorganismes de la flore intestinale, une autre partie est absorbée dans le sang et le restant est éliminé dans les selles. Une partie de l’urobilinogène sanguin est éliminé par le rein et se retrouve dans l’urine alors que le restant retourne au foie pour être envoyé par la bile dans le tube digestif. Voici un schéma récapitulatif de ce cycle : (schéma 1)
Ictère néonatal proprement dit :
L’ictère néonatal à bilirubine libre est dans la plupart des cas transitoire et physiologique. Il est lié à une surproduction de bilirubine chez le nouveau-né, une immaturité du foie et une augmentation du cycle entéro-hépatique. Une hyper-bilirubinémie pathologique peut être liée à une augmentation de la synthèse de bilirubine (hémolyse accrue ou résorption d’hématomes), à une augmentation du cycle entéro-hépatique (en cas de jeûne par exemple) ou à une anomalie (fonctionnelle ou constitutionnelle) du transport ou de la conjugaison intra-hépatocytaire de la bilirubine. Les ictères à bilirubine conjuguée ou mixte correspondent à une cholestase néonatale (inertie de la bile à l’intérieur des canaux biliaires situés dans le foie du nouveau-né par obstruction des voies biliaires ou par une diminution de la sécrétion de la bile due à une anomalie de fonctionnement des cellules hépatiques). Ils sont toujours pathologiques.
Classification de l’ictère
Selon le type de bilirubine accumulé, qui dépend à la base du mécanisme de l’ictère, on distingue l’ictère à bilirubine libre (le plus fréquent) et l’ictère à bilirubine conjuguée.
Causes de l’ictère
Les étiologies de l’ictère néonatal et de l’ictère en général sont multiples mais relèvent de manière générale de 4 grandes catégories : hémolytique (en relation avec une dégradation élevé des globules rouges), infectieuse, cholestatique, métabolique (en relation avec l’ensemble des réactions et transformations biochimiques qui interviennent dans la dégradation de l’hémoglobine et la formation de bilirubine) :
L’ictère hémolytique
Ce type d’ictère est due à une destruction accrue de globules rouges qui engendre une augmentation de production de bilirubine (cf. schéma 1) habituellement très précoce, débutant avant la 24ème heure, il progresse très rapidement. Il se manifeste par une pâleur et une hépato-splénomégalie (augmentation de la taille du foie et de la rate). L’origine de l’hémolyse relève de plusieurs mécanismes :
Incompatibilité du rhésus
Chez la femme enceinte, les incompatibilités rhésus apparaissent chez une femme du groupe rhésus (-) ayant un enfant rhésus (+). Dans ce cas, 2 situations sont possibles :
- Soit que la mère n’a jamais eu de contacte avec l’antigène Rh(+), et là il n’y aucun problème
- Soit qu’elle est immunisée contre le rhésus (+), c’est-à-dire ayant eu un contact avec du sang Rh(+) (après une grossesse précédente au cours de laquelle elle a porté un enfant Rh(+) ou à cause d’une transfusion de sang Rh (+) par exemple ou autre circonstance qui a provoqué son immunisation) contact suite auquel sont système immunitaire a fabriqué des anticorps anti-Rh(+) (parce que pour le corps de la mère, ce contact avec des globules rouges différents des siens représente une intrusion, une menace qui le poussent à fabriquer ces anticorps pour lutter contre cet intrus si jamais il s’introduit à nouveau dans l’organisme de la mère et c’est cela même le principe général de la vaccination : mettre l’organisme en contact avec un germe « affaibli » pour qu’il puisse se préparer à une infection ultérieure par ce même germe et la combattre plus facilement), et dans ce cas, les anticorps anti-Rh(+) vont passer dans le sang du fœtus et vont commencer à attaquer et à détruire ses propres globules rouges causant ainsi un ictère néonatal.
Incompatibilité ABO
La situation la plus courante est celle où la mère est de groupe O, et le nouveau-né de groupe A ou B. l’hémolyse dans ce cas est le plus souvent moins marquée et surtout retardée par rapport à l’hémolyse par incompatibilité rhésus. A la différence de l’incompatibilité rhésus, l’hémolyse dans le cadre de l’incompatibilité ABO peut atteindre le nouveau-né premier né.
Les déficits enzymatiques du globule rouge
Les déficits enzymatiques en G6PD ou en PK peuvent être à l’origine d’une hémolyse néonatale.
Maladie de Minkowski-Chauffard
Appelée aussi microsphérocytose héréditaire, Il s’agit d’une maladie familiale et héréditaire se caractérisant par la présence d’hématies sphériques (globules rouges prenant la forme d’une petite sphère), de petites taille et fragiles. Cette maladie se caractérise par des épisodes hémolytiques évoluant par poussées.
Ictère infectieux
L’ictère est d’apparition plus ou moins précoce, et se caractérise par le fait qu’il est souvent mixte (bilirubine libre et conjuguée).
Dans le cadre particulier des infections virales et parasitaires responsables d’une fœtopathie ou d’une embryo-fœtopathie, l’ictère n’est qu’un élément parmi tant d’autres qui font ensemble le tableau clinique très complexe associant :
- retard de croissance intra-utérin.
- syndrome dysmorphique, microcéphalie.
- Hépato-splénomégalie.
- Purpura
- éruption
L’ictère simple
C’est un diagnostic d’élimination, c’est-à-dire qu’on n’a le droit de poser ce diagnostic que si toutes les possibilités qu’on vient de citer aient été éliminées. Ce type d’ictère est d’autant plus probable que le nouveau-né est prématuré. C’est un ictère bénin dû à un déséquilibre temporaire entre la production et l’élimination de la bilirubine et dont l’origine relève de 3 facteurs plus ou moins associés selon les cas:
- excès relatif de production dû à la « fragilité » des globules rouges du nouveau-né
- immaturité de la fonction de glucurono-conjugaison hépatique vis-à-vis de cette bilirubine, qui est nécessaire à son élimination
- le recyclage entéro-hépatique
Un certain nombre de nouveau-né peuvent présenter un ictère simple caractérisé par :
- son apparition retardée (2ème ou 3ème jour après la naissance)
- son évolutivité lente
- l’absence d’anomalie biologique (pas d’anémie, d’incompatibilité, test de Coombs négatif).
- absence de toute anomalie clinique (hépatomégalie ou splénomégalie, infection, hémolyse…).
- urines claires
- selles de coloration normale
L’ictère néonatal prolongé
Par opposition à l’ictère simple qui décroit généralement en une dizaine de journées, l’ictère prolongé est une persistance ou une réapparition d’ictère chez un enfant ayant passé la période néonatale sans incident de gravité notable. L’approche diagnostique repose sur le caractère conjugué ou non de la bilirubine.
Ictère à bilirubine non conjuguée
La bilirubine dans ce cas est en grande partie ou, parfois même, exclusivement de nature non conjuguée traduisant un phénomène hémolytique dont l’origine, dans la plupart des cas, est une incompatibilité ABO. Parfois, cette hyper-bilirubinémie reste cliniquement muette (pas d’anémie, pas d’hépatomégalie ni de splénomégalie, des selles normalement colorées et des urines claires), là le clinicien peut évoquer :
- L’ictère au lait maternel : L’arrêt temporaire de l’allaitement ou le chauffage du lait à une température de 56°C entraînent une régression de l’ictère qui, en faisant la preuve de son origine, autorise la reprise de l’allaitement sans autre contrôle
- D’autres pathologies qui donnent aussi une hyper-bilirubinémie : hypothyroïdie congénitale, maladie de Crigler et Najjar, maladie de Gilbert…
Ictère à bilirubine conjuguée
La cholestase du nourrisson en est l’origine la plus fréquente elle donne, en règle générale, une hépatomégalie et une décoloration plus ou moins complète des selles. Le diagnostic repose sur l’échographie. La cholestase peut être intra ou extra-hépatique
Traitements
Ictère hémolytique par incompatibilité Rhésus
L’exsanguino-transfusion (EST : Remplacement d’une grande quantité (jusqu’à 2 à 3 fois la totalité du volume sanguin entier) de sang ou de globules rouges d’un malade par le sang (plus précisément les globules rouges) d’un donneur (sain)) est le traitement de choix. L’EST se fait en sang O rhésus négatif (non forcément iso-groupe) par voie ombilicale (cathéter veineux). Le traitement préventif de cette immunisation consiste en l’injection systématique, chez toute femme rhésus négatif, dans les 48 heures suivant un accouchement ou une interruption de grossesse, de gammaglobulines anti-D.
L’ictère infectieux
Le traitement est complexe car tous les facteurs de risque sont présents chez ces patients. Il consiste en règle générale en une antibiothérapie à large spectre avec correction des troubles métaboliques et le maintien d’une albuminémie correcte en faisant des perfusions d’albumine humaine. On peut aussi avoir recours à la photothérapie.
L’ictère simple
Une surveillance s’impose surtout vis-à-vis des enfants de petit poids à la naissance, des prématurés, ou de ceux présentant un facteur de risque aggravant. Le traitement par une photothérapie discontinue (associée ou non selon les cas à une perfusion d’albumine) est généralement suffisant, sa durée sera fonction de l’évolution de la bilirubinémie. On peut avoir recours au clofibrate (Lipavlon®) qui permet efficacement, en dose unique (50mg/kg) de diminuer l’amplitude de l’hyper-bilirubinémie.
